مرض الهزال المزمن
| مرض الهزال المزمن | |
|---|---|
| Chronic wasting disease | |
| معلومات عامة | |
| الاختصاص | طب الجهاز العصبي، وطب بيطري |
| من أنواع | مرض حيواني ، واعتلال دماغي إسفنجي قابل للانتقال |
| الأسباب | |
| الأسباب | عدوى |
| تعديل مصدري - تعديل | |

(أ) يظهر القسم النسيجي للآفات النموذجية من اعتلال دماغي للأيائل في النواة الحركية الظهرية للعصب المبهم، في بصلة (نخاع مستطيل) للغزلان المريض. تلاحظ التغييرات «الإسفنجية»، الفجوات داخل العين، ودباق عصبي معتدل (باستخدام صبغة الهيماتوكسيلين واليوزين، تكبير بسعة 1.003x).
(ب) مستنقع اميلويد بلازما غنية بالصفائح الدموية ملطخة بكيمياء الأنسجة المناعية (بني اللون) وتحيط بها فجوات (تكبير 1803x).
(س) رواسب عصبية محيطية وخارج الخلية من الجزيئات البروتينية المسببة للعدوي في الغزلان المصابة بالمرض (التكبير الأصلي 1803x).
(د)ودائع من الجزيئات البروتينية المسببة للعدوي في المراكز الجرثومية للجريبات اللمفاوية في لوزتي الغزلان (كيمياء الأنسجة المناعية، تكبير 503x
مرض الهزال المزمن أو مرض الالتهاب المزمن (اختصارًا CWD) هو اعتلال دماغي إسفنجي معد (TSE) ومميت شبيه بمرض جنون البقر أو قعاص الغنم أو مرض كروتزفيلد جاكوب عند البشر، يؤثر المرض تحديدا في (غزال البغل، أو الغزلان ذي الذيل الأبيض، الأيائل، حيوانات الأميركة الشمالية الموظ الشبيه بالإلكة، والرنة).[1] ولا تزال أسباب هذا المرض الناشئ غير مفهومه بشكل جيد حتى الآن.
اعتبارا من عام 2016، تم العثور على هذا المرض في فصائل الأيائل والغزلان فقط.[2] تم التعرف عليه لأول مرة في عام 1967 على أنه متلازمة «هزال» سريرية لدى غزلان البغل في منشأة أبحاث الحياة البرية في شمال ولاية كولورادو، بالولايات المتحدة الأمريكية، وقد تم تحديده في عام 1978 على أنه اعتلال دماغي إسفنجي قابل للإنتقال لينتشر إلى مجموعات أخرى في 23 ولاية أمريكية وولايتين في كندا.[3] ويتم تمييز أعراض المرض عن طريق فقدان وزن مزمن يؤدي إلى الوفاة. وحتى الآن لا توجد علاقة معروفة بين المرض وأي اعتلالات دماغية إسفنجية قابلة للإنتقال لدى فصائل أخرى من الحيوانات أو الأشخاص.
على الرغم من أن التقارير الواردة في الصحافة الشعبية ترجح وجود إصابات بشرية بهذا المرض، إلا أن دراسة أجرتها مراكز السيطرة على الأمراض والوقاية منها تشير إلى «أن هناك حاجة إلى دراسات معملية ووبائية لرصد إمكانية حدوث مثل هذه العدوى».[4] وخلصت الدراسة الوبائية كذلك إلى أنه وعلى سبييل الوقاية «يجب على الصيادين تجنب تناول أنسجة الغزلان والأيائل المعروفة بإيواء العامل المرضي (على سبيل المثال، المخ والحبل الشوكي والعينين والطحال واللوزتين والعقد اللمفاوية) من المناطق التي تم تحديدها كمخازن للمرض».[4]
تاريخ[عدل]
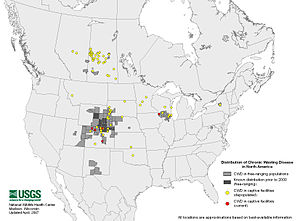

ظهر المرض في أمريكا الشمالية، وتحديدا في الولايات المتحدة، قبل انتشاره إلى كندا من خلال التجارة أو الاتصال المباشر والعدوى بين الغزلان البرية والقطعان. حتى الآن لا يزال أصل وطريقة انتقال الجزيئات البروتينية المسببة للعدوي بالمرض غير معروفة، لكن الأبحاث الحديثة تشير إلى أن هذه الجزيئات البروتينية المسببة للعدوي يمكن أن تفرز عن طريق الغزلان والأيائل وتنتقل عن طريق تناول زراعة الأعشاب في التربة الملوثة.[5][6]
وقد تم اكتشاف إصابة الحيوانات الأسيرة والمولودة في البرية بالمرض. واستنادًا إلى علم الأوبئة، يُعتقد أن نقل المرض يكون أفقيًا أي من الحيوان إلى الحيوان. قد تحصل العدوى كذلك عن طريق نقل المرض من قبل الثدييات الأم. كما إن لعاب الغزلان المصاب قادر على نشر الجزيئات البروتينية المسببة للعدوى.[7] ويرتبط التعرض للمرض بين الحيوانات ارتباطا وثيقا بمشاركة الغذاء ومصادر المياه الملوثة بالجزيئات البروتينية المسببة للعدوى التي تسيل من الغزلان المريضة.[8]
تم تحديد المرض لأول مرة في عام 1967 في قطيع مغلق من غزال البغل الأسرى في أجزاء متتالية من شمال شرق ولاية كولورادو. وفي عام 1980، تم تشخيص المرض على أنه اعتلال دماغي إسفنجي معد (TSE). تم التعرف عليه لأول مرة في الأيائل والبغال البرية في عام 1981 في كولورادو وولاية وايومنغ، وفي الأيائل المنزلية المرعية في عام 1997.[9][10][11]
في مايو 2001، تم العثور على مرض الهزال المزمن في أيل البراري في الزاوية الجنوبية الغربية من ولاية نبراسكا (المحادية لولايتي كولورادو ووايومنغ) وفيما بعد في مناطق إضافية في غرب نبراسكا. ويشار إلى المنطقة المحدودة في شمال كولورادو، جنوب وايومنغ، وغرب نبراسكا والتي تم العثور فيها على غزلان وأيائل وموظ مصابية بالمرض باسم المنطقة المتوطنة. وقد توسعت المنطقة في عام 2006 لتشمل ست ولايات، بما في ذلك أجزاء من ولاية يوتا الشرقية وجنوب غرب ولاية داكوتا الجنوبية وشمال غرب كنساس. كما تم العثور أيضا على حالات في المناطق الغير المجاورة للمنطقة الموبوءة في وسط ولاية يوتا ونبراسكا. وتعد حدود المناطق المصابة غير محددة بشكل جيد، بسبب إمكانية حدوث المرض المنخفضة ومقدار أخذ العينات الذي لا يكون مناسبًا لاكتشافه.
في عام 2002، تم اكتشاف المرض في الأيائل البرية في جنوب وسط ويسكونسن وشمال إلينوي وفي منطقة معزولة في جنوب نيو مكسيكو. في عام 2005، تم العثور عليها كذلك في فصيلة الغزلان ذي الذيل الأبيض في نيويورك وفي مقاطعة هامبشاير (فرجينيا الغربية).[12] في عام 2008، تم اكتشاف أول حالة أيائل مؤكدة مصابة بالمرض في ميشيغان بمحمية مغلقة لتربية الغزلان. كما توجد في المقاطعات الكندية في ألبرتا وساسكاتشوان.
في شباط / فبراير 2011، أبلغت وزارة الموارد الطبيعية في ولاية ماريلاند عن أول حالة مؤكدة للمرض في تلك الولاية. كان الحيوان المصاب غزالا من فصيلة الأيائل ذات الذيل الأبيض قُتل على يد صياد.[13]
الأبحاث السريرية[عدل]
بينت الأبحاث السريرية أن معظم حالات المرض تحدث عند الحيوانات البالغة، في المقابل كان أصغر حيوان تم تشخيصه طبيعيا يبلغ 17 شهرًا. كلما تقدم المرض كان قاتلا. وتتجلى العلامات الأولى في صعوبات في الحركة وخسارة في الوزن مع مرور الوقت، كما تحدث تغيرات سلوكية في معظم الحالات، بما في ذلك انخفاض التفاعل مع الحيوانات الأخرى، فتور، اخفاض الرأس، الارتعاش، المشي المتكرر في أنماط محددة، العصبية. ولوحظ الإفراط في إفراز اللعاب وجرش الأسنان. وتظهر معظم الغزلان إفراطا في الشرب والتبول. وتعد زيادة الشرب وفرز اللعاب عوامل مساهمة في انتشار المرض.[9]
العامل المسبب[عدل]
يتسبب بمرض الهزال المزمن بريون، وهو شكل غير طبيعي من البروتين الطبيعي، المعروف باسم بروتين البريون (PrP)، الذي يعد الأكثر شيوعًا في الجهاز العصبي المركزي (CNS)، ولكنه قادر على الانتشار إلى الجهاز العصبي المحيطي (PNS)، ليصيب لحوم أو عضلات الغزلان والأيائل.
ويتجلى الخلل في بروتين البريون (PrP) في أساسه الوراثي وفي متغير معين من جين PRNP المكوّن للبروتين المحمي والذي يحفظ بشكل كبير بين الثدييات حتى تم العثور عليه وتسلسله في الغزلان. يصيب بروتين البريون (PrP) الحيوان المضيف عن طريق تشجيع تحويل البروتين الخلوي العادي (PrPC) إلى بريون شاذ (سواء PrPres أو PrPd). ويرتبط تراكم الـ PrPd في الدماغ بتحلل عصبي عام للخلايا العصبية.[9][10][11]
ولكن لم يُعثر على أي أثر للبريونات في 10% من حالات المرض، مما يدفع البعض إلى الاشتباه في وجود عامل آخر مسبب للمرض، وأن البريون ما هو إلا محض مؤشر على حدوث المرض.
ومن بين النظريات التي حازت على دعم بعض العلماء منذ عام 2017 أن السبب الحقيقي وراء المرض هو نوع من البكتيريا عديمة الجدران الخلوية، وهي تُدعى سبيرولازما (Spiroplasma). وقد حاول عالم الأعصاب فرانك باستيان من جامعة لويزيانا أن يزرع بكتيريا السبيروبلازما داخل أدمغة الحيوانات المصابة عدة مرات، ولكن محاولاته باءت بالفشل، حيث ظلت خلايا البكتيريا تتكاثر لمدة 10 ساعات ثم ماتت. ولكن في النهاية زعم باستيان أنه نجح في استخراج عينة بكتيريا من أدمغة الأيائل المصابة بمرض الهزال المزمن، بالإضافة إلى عدة خراف مصابة بقعاص الغنم، وذلك بعدما استبدل الوسط المغذي بنوع آخر. ونتيجة لذلك استطاعت أعماله أن تجذب انتباه وكالة الصيد في بنسيلفانيا وجامعة ألاباما. وتمتلك بكتيريا السبيروبلازما عدة خصائص تتميز بها عوامل مرض الهزال المزمن، ومنها مقاومة الحرارة والإشعاع. وعلى حسب الاعتقاد الحالي فقد يحفز الجسم إنتاج البريون كعامل دفاع ضد السبيروبلازما. وقد تتواجد البريونات بغرض وقاية الجسم من البكتيريا عن طريق تنشيط جهاز المناعة التكيفي (أو المناعة المكتسبة).[14]
علم الجينات[عدل]
وتنتمي الأليلات التي تحتوي على شفرة الليوسين في الكودون رقم 132 في فصيلة الإلكة إلى ثلاثة تصنيفات: متماثلة الزيجوت LL، أو متماثلة الزيجوت ML، أو مغايرة الزيجوت ML. وتتميز الأفراد الحاملة للأليلات من النوع الأول بمقاومة ظهور أعراض مرض الهزال المزمن، أما النوع الثاني والثالث فتظهر عليهم أعراض المرض في زمن قصير نسبيًا.
ويتسبب الكودون رقم 96 بأشكاله المختلفة في تعطيل تطور المرض وتأخير ظهور الأعراض السريرة عند فصيلة الأيلييات بيضاء الذيل.[15]
جهود التحكم في انتشار المرض وإبادته[عدل]
في عام 2012 نشرت منظمة APHIS مقالة تناقش فيها تدشين برنامج تحكم تطوعي لمنع انتشار المرض. ويعتمد هذا البرنامج على نهج المعايير الدنيا الاختيارية وبرامج ترخيص الرعي في محاولة لمنع انتقال نواقل المرض عبر الولايات. وهو مشروع يستند على إطار إدارة المجازفة. وبحلول أغسطس 2019 استطاعت المنظمة أن تتعامل مع هذه المشكلة عن طريق تطبيق هذا البرنامج.
وتمكنت وزارة إدارة الغابات الكندية في كيبك من إجراء 9500 اختبار في الفترة بين عام 2007 وخريف 2018 على البهائم، ونتج عن ذلك العثور على حالة واحدة مصابة بالمرض في سبتمبر 2018.[16]
وقد حفز اكتشاف المرض في سبتمبر 2018 في كيبك أن تشرع الحكومة في عملية ذبح جماعي تضمنت 3500 بهيمة على مدار شهرين قبل أن تغلق شركات صناعة لحوم الأيائل أبوابها للأبد.[17] وقد أمرت الوكالة الكندية لفحص الأغذية بهذه الإبادة بالإضافة إلى تطهير التربة من البكتيريا بعمق 10 بوصات في بعض المناطق الواقعة على رقعة الأرض المستهدفة بمساحة 1000 هكتار.[16] وبعد انتهاء عملية البحث، قامت الوكالة بفحص جميع الحيوانات للتأكد من خلوها من مرض الهزال المزمن قبل أن تطلقها إلى السوق. ولكن منتجي اللحوم عبروا عن استيائهم من شح إمدادات الأيائل[18] ومن ثم أعلنت الوكالة عن عزل مساحة من الأرض بنحو 400 كم مربع، وحظرت فيها ممارسة أنشطة الصيد ونصب الشراك. ثم شرعت الحكومة في إبادة البهائم البرية على مدار شهرين. وفي العادة كان معدل الإبادة يتراوح من 70 إلى 100 حيوان كل أسبوع. ولكن بعد اضطرار منتجي اللحوم إلى إغلاق أبوابهم اقترب معدل الإبادة إلى نحو 500 بهيمة كل أسبوع.[19]
وقد اتضح لاحقًا في أغسطس 2019 أن جميع الحيوانات المصابة بالمرض في كندا قد دُفنت أو احترقت بالفعل بحلول عام 2014. ولكن لسبب ما سمحت الوكالة الكندية لفحص الأغذية للحيوانات الناشئة في المزارع المصابة بالعدوى أن تُباع علنًا في الأسواق لعدم وجود دافع قوي للاشتباه في تلك الحيوانات على حد قولهم. ونتيجة لذلك فقد تم بيع 131 أيل من أحد القطعان المصابة بالعدوى من ألبيرتا للاستهلاك الآدمي.[19]
انتشار المرض على مستوى السكان[عدل]
في أوروبا[عدل]
سُجلت أول حالة إصابة بمرض الهزال المزمن في أوروبا عام 2016 في جنوب النرويج في أحد قطعان الرنة. فقد عثر العلماء على أنثى الرنة النافقة وهي تحتضر، وأظهرت نتائج الفحص الروتيني أثناء تشريح الجثة إصابة الحيوان بمرض الهزال المزمن، وهو ما لم يتوقعه العلماء حينئذ. ولا يزال مصدر انتشار المرض في النرويج مجهولًا، وذلك على خلاف كوريا الجنوبية حيث اتضح أن الأيائل المصابة بالعدوى جائت من كندا. وتفرض النرويج تشريعات وقوانين صارمة تحظر استيراد الحيوانات الحية والأيائل بصفة خاصة إلى داخل البلد. وتطبق النرويج برنامج لمراقبة انتشار قعاص الغنم منذ عام 1997؛ وبالرغم من عدم تسجيل أي حالات عدوى بالقرب من قطعان الأيائل، ولكن من الجائز أن قطعان الخراف القريبة من تلك المنطقة هي مصدر العدوى المحتمل.[20]
وفي شهر مايو ويونيو من عام 2016 عُثر على ذات المرض في حالتين من حيوانات الموظ في منطقة سيلبو التي تبعد 300 كم شمالًا عن المنطقة الأولى.[21] وبانتهاء شهر أغسطس تم التأكيد على وجود حالة رابعة في حيوان رنة بري بعد إصابته بطلق ناري في ذات المنطقة التي عثرت فيها على الحالة الأولى.[22]
ونتيجة لذلك قامت جمعية البيئة التابعة لحكومة النرويج في عام 2017 باصدار قواعد ارشادية لصيادي حيوان الرنة في تلك المنطقة. وتحتوي الارشادات على طريقة التعرف على أعراض مرض الهزال المزمن في الحيوانات البرية لتقليل احتمال انتشار العدوى، بالإضافة إلى قائمة بالأدوات اللازمة للصيادين لأخذ عينات من الحيوانات المصابة وإرسالها للجهات المختصة.[23]
وفي مارس 2018 صرح مجلس سلامة الغذاء في فنلندا أنه تم تشخيص أول حالة إصابة بمرض الهزال المزمن في فنلندا في حيوان الموظ بعمر 15 سنة والذي مات ميتة طبيعية في بلدية كومو في إقليم كاينو. وقبل اكتشاف هذه الحالة، كانت النرويج البلدة الوحيدة التي شُخص فيها هذا المرض من بين بدان المنطقة الاقتصادية الأوروبية. ولم يصب حيوان الموظ بنفس نوع المرض المعدي المتواجد في أمريكا الشمالية، بل كان المرض أقرب إلى النوع المتواجد في النرويج، وهو نوع غير اعتيادي يظهر بصفة عرضية في أفراد فصيلة الأيلييات. وتقوم الحكومة الفنلندية بفحص الأيائل البرية النافقة منذ عام 2003. ولم يظهر المرض في أي حالة من بين 2500 عينة فُحصت حتى الآن. وقد تم إيقاف تصدير الأيائل الحية من فنلندا إلى البلدان الأخرى مؤقتًا كإجراء وقائي لمنع انتشار المرض، وسوف يُزود الصيادون بمزيد من الارشادات قبل حلول موسم الصيد القادم إن كان الأمر مناسبًا. ولكن لن يتم منع تصدير وبيع لحوم الأيائل. ويعتبر لحم الموظ آمن للاستهلاك الآدمي، حيث أن الأنسجة الدماغية والعصبية في البهائم المصابة هي فقط التي تحتوي على البريونات.[24]
وفي مارس 2019 شخص المعهد القومي للطب البيطري في السويد أول حالة إصابة بالمرض. حيث عُثر على أنثى موظ هزيلة بعمر 16 سنة في بلدية أريبلوك في مقاطعة نوربوتن، وكانت تحوم حول المكان بدون خوف من البشر، ومن المحتمل أنها كانت عمياء. ومن ثم قُتلت قتلًا رحيمًا وأرسلت رأسها إلى الجهات المختصة للفحص. وبالفعل تم العثور على العدوى في جذع الدماغ، ولكن لا وجود للعدوى في أنسجة العقد الليمفاوية. وفي مايو 2019 شُخصت حالة أخرى مشابهة على بعد 70 كم من شرق المنطقة الأولى. فقد كانت الحالة الثانية عبارة عن أنثى موظ هزيلة بعمر 16 سنة في بلدية أرفيدسياور، وقُتلت بطريقة مشابهة. وكانت الظروف المحيطة بتلك الحالات مشابهة لتلك التي في النرويج وفنلندا. ولذلك دشن الاتحاد الأوروبي برامج مراقبة العدوى في الفترة ما بين عام 2018 و2020. ومن المفترض أن يتم فحص 6000 من الأيلييات مما يتضمن الأيلييات الطليقة وأيائل المزارع الحمراء والرنة شبه المستأنسة.[25]
التشخيص[عدل]
تم التشخيص بناء على فحص تشريحي للجثث وعدة اختبارات. وبالرغم من أن فحص الجثث ليس نهائياً، حيث أن العديد من الحيوانات تموت مبكراً خلال بداية تطور المرض والظروف الغير محددة؛ إلا أنه تأكد أن العلامات العامة مثل التقهقر الصحي والإصابة بذاء الرئة الشفطي هي من العلامة الشائعة التي قد تكون السبب الحقيقي للوفاة.
في الفحص المجهري، تشبه آفات المرض في الجهاز العصبي المركزي تلك الخاصة بالاعتلاات الدماغية الإسفنجية المعدية الأخرى. بالإضافة إلى ذلك، يستخدم العلماء كيمياء الأنسجة المناعية لاختبار وجود بروتين البريون الشاذ الغير الطبيعي في أنسجة الدماغ واللمف ونسيج الغدد الصم العصبية بغية تشخيص المرض. وتعتبر نتائج كيمياء الأنسجة المناعية (IHC) الإيجابية في مزلاج الدماغي المعيار الذهبي.[9]
اعتبارا من عام 2015، لم يعد ممكنا إجراء أي اختبار تشخيصي تجاري على الحيوانات الحية. في المقابل يمكن استخدام اختبار بيولوجي، بأخذ السوائل من الغزلان المشكوك في إصابتها بالعدوى وحقنها في فئران معدلة وراثياً التي تعبر عن بروتين البريون البري، لتحديد إمكانيية الإصابة، ولكن الأمر يخلق نوعا من المشاكل الأخلاقية وليس قابلا للتطور.[9]
تم إجراء تقنية خزعة جديدة لغزلان حية، ولكن يبدو أنها فعالة فقط في غزال البغل والغزلان ذي الذيل الأبيض، وليس الأيائل.[26]
العدوى والانتشار[عدل]
تنتقل العدوى «أفقيا» (أي من الأفراد إلى الأفراد وليس عموديا، من الآباء إلى الأحفاد). ويتم ذلك بواسطة آلية أو أكثر غير معروفة لحد الآن. يطرح النشر السريع في الحيوانات البرية تحديًا بيئيًا حقيقيًا[27] بالنسبة للصيادين والأطباء البيطريين والمحافظين على الطبيعة، خاصة أن العلامات السريرية لا تكون ظاهرة خلال جزء كبير من مراحل تطور المرض، وكذلك محدودية أدوات التشخيص قبل الموت، خاصة لتتبع الحيوانات البرية في الحرية. بالإضافة إلى ذلك، غالبًا ما يفتقر علماء الأوبئة البيئية إلى المعلومات عن سلالات الحيوانات وعوامل الخطر التي قد يتعرضون لها.
الانتقال المباشر[عدل]
وفقا للبيانات المتاحة:
- يمكن انتقال هذا الاعتلال الدماغي عن طريق التلقيح الدماغي للأبقار والأغنام والماعز، ولكن لم تظهر أي دراسة أن الحيوانات الأليفة يمكن أن تكون عرضة للتعرض للمرض عن طريق الفم.[28] حيث يعتبر المسلك الفموي واحدا من الطرق الطبيعية المفترضة للتعرض ل TSEs، والتي يعتقد أنه الأكثر احتمالا لدى الغزلان؛[28]
- يمكن أن ينتقل مرض الهزال المزمن مباشرة عن طريق الاتصال بالحيوانات المصابة وأنسجتها الجسدية وسوائلها الجسدية.[29][30]
- خلال الأبحاث الحديثة اكتشف على أن أمهات غزال إلكة الجبل الجليدي إلك الجبل الجليدي المصابين بالمرض، حدثت نسبة عالية (بلغت ٪80) من نقل الأمهات للمرض إلى الجنين، بغض النظر عن فترة الحمل.[30] على الرغم من كونه ليس عاملا على تطور الجنين، إلا أن هذا يشير إلى أن انتقال المرض من الأمهات قد يكون وسيلة مهمة أخرى للنقل المباشر للمرض.
الأبحاث التجريبية[عدل]
كشفت الأبحاث التجريبية أنه بالإضافة إلى فصائل الغزلان حيث يتواجد المرض بشكل طبيعي، أن كلا من الغزلان ذات الذيل الأسود والأيائل الأوروبية الحمراء وحيوانات الرنة والكاريبو، عرضة بشكل طبيعي للإصابة بالمرض.[31] كما تم إخضاع العديد من فصائل الثدييات الأخرى بشكل تجريبي للمرض عن طريق الفم، أوالتلقيح الدماغي للمرض.[29] وتشمل هذه الأنواع القرود والأغنام والماشية والحيوانات الأليفة والفئران والقوارض.[32]
أظهرت دراسة لحالة تجريبية لانتقال عدوى المرض عن طريق الفم في حيوان الرنة أن بعض سلالات حيوان الرنة قد تكون عرضة للأصابة بالمرض، بينما قد تحمي المجموعات الفرعية الأخرى من المرض في مجموعات القطعان البرية. لم تظهر أي من حيوانات الرنة المشاركة في التجربة أعراضا للمرض، يحتمل أن تكون دليلاً على مقاومة سلالات المرض المختلفة.[33]
الانتقال الغير المباشر[عدل]
تم ربط الانتقال البيئي الغير المباشر بالاتصال مع السوائل الجسدية والأنسجة الجسدية المصابة، وكذلك الاتصال بالبيئات الملوثة. فبمجرد وجود البريونات المعدية في الطبيعة تستطيع البقاء لسنوات عديدة. وهكذا، فإن تحلل الجثث المريضة، مثل «أكوام الأمعاء» المصابة التي يصطادها الصيادين أثناء قيامهم بملء محاصيلهم من قطعان الغزلان بالإضافة إلى البول واللعاب والبراز وقرن الوعل الخاص با الحيوانات المصابة بالمرض والتي تترسب في البيئة، كلها عوامل لديها القدرة على خلق بيئة معدية للمرض.[9]
الإصابات البشرية[عدل]
اعتبارا من عام 2016، لم يتم العثور على أي دليل يؤكد انتقال العدوى إلى الإنسان سواء عن طريق الإستهلاك أو الانتقال المباشر ولكن الأمر لا يزال موضوعًا للمراقبة والأبحاث في مجال الصحة العامة.[11]
الأبحاث[عدل]
تركز الأبحاث على طرق أفضل لرصد المرض في الطبيعة عن طريق اختبارات تشخيص للحيوانات البرية الحية، تطوير اللقاحات، استعمال طرق أفضل للتخلص من الحيوانات النافقة بسبب المرض لتطهير البيئة، حيث يمكن أن تستمر البريونات في التربة، واستعمال طرق أفضل للمراقبة وإمداد الغذاء. بالإضافة إلى حل النقاشات الخاصة بإدارة ورعاية الغزلان.[34]
مراجع[عدل]
- ^ (بالإنجليزية) Williams ES, Miller MW « Chronic wasting disease in deer and elk in North America » International Office of Epizootics 2002, 21(2):305-316 ببمد: 11974617 (Résumé) نسخة محفوظة 2020-03-12 في Wayback Machine
- ^ Deadly animal prion disease appears in Europe نسخة محفوظة 2017-11-19 في Wayback Machine
- ^ "Chronic Wasting Disease". الولايات المتحدةGS National Wildlife Health Center. 21 مايو 2013. مؤرشف من الأصل في 2019-04-03. اطلع عليه بتاريخ 2014-12-05.
- ^ ا ب Belay، E.D.؛ Maddox, R.A.؛ Williams, E.S.؛ Miller, M.W.؛ Gambetti, P.؛ Schonberger, L.B. (يونيو 2004). "Chronic Wasting Disease and Potential Transmission to Humans". Emerging Infectious Diseases. CDC. ج. 10 ع. 6: 977–984. DOI:10.3201/eid0905.020577. PMC:3323184. PMID:15207045. مؤرشف من الأصل في 2011-08-05. اطلع عليه بتاريخ 2008-04-08.
- ^ "Study Shows Prions Stick Around In Certain Soils". Science Daily. 17 سبتمبر 2003. مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2006-10-23.
- ^ "New Research Supports Theory That Indirect Transmission Of Chronic Wasting Disease Possible In Mule Deer". Science Daily. 19 مايو 2004. مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2006-10-23.
- ^ Mathiason CK، Powers JG، Dahmes SJ، Osborn DA، Miller KV، Warren RJ، Mason GL، Hays SA، Hayes-Klug J، Seelig DM، Wild MA، Wolfe LL، Spraker TR، Miller MW، Sigurdson CJ، Telling GC، Hoover EA (6 أكتوبر 2006). "Infectious prions in the saliva and blood of deer with chronic wasting disease". Science. ج. 314 ع. 5796: 133–6. DOI:10.1126/science.1132661. PMID:17023660.
- ^ Ernest، Holly B.؛ Hoar، Bruce R.؛ Well، Jay A.؛ O'Rourke، Katherine I. (1 أبريل 2010). "Molecular genealogy tools for white-tailed deer with chronic wasting disease". Canadian Journal of Veterinary Research = Revue Canadienne De Recherche Veterinaire. ج. 74 ع. 2: 153–156. ISSN:1928-9022. PMC:2851727. PMID:20592847.
- ^ ا ب ج د ه و Haley NJ, Hoover EA. Chronic wasting disease of cervids: current knowledge and future perspectives. Annu Rev Anim Biosci. 2015;3:305-25. Review. 25387112
- ^ ا ب USGS National Wildlife Health Center Frequently asked questions concerning Chronic Wasting Disease (CWD) Page last updated May 21, 2013; page accessed April 25, 2016 نسخة محفوظة 2020-04-06 في Wayback Machine
- ^ ا ب ج Patrice N Klein, CWD Program Manager USDA /APHIS. Chronic Wasting Disease WHHCC Meeting – 5–6 February 2013 نسخة محفوظة 2015-01-28 في Wayback Machine
- ^ "Chronic Wasting Disease". West Virginia Division of Natural Resources. 1 أغسطس 2008. مؤرشف من الأصل في 2019-02-24.
- ^ "Wasting Disease Confirmed in State". 13 فبراير 2011. مؤرشف من الأصل في 2012-03-24.
- ^ Warner، Darren (16 يوليو 2018). "The War Over Explaining Chronic Wasting Disease". deeranddeerhunting.com. مؤرشف من الأصل في 2019-04-22.
- ^ Prusiner، Stanley B. (2001). "Neurodegenerative Diseases and Prions". New England Journal of Medicine. ج. 344 ع. 20: 1516–1526. DOI:10.1056/NEJM200105173442006. PMID:17098992.
- ^ ا ب Lorange، Simon-Olivier. "Pourquoi avoir abattu 3000 cerfs dans les Laurentides? | Simon-Olivier Lorange | Environnement". La Presse. Lapresse.ca. مؤرشف من الأصل في 2019-08-14. اطلع عليه بتاريخ 2019-02-12.
- ^ "DU CERF DE BOILEAU, IL N'Y EN AURA PLUS". La Presse, ltée. 21 décembre 2018. مؤرشف من الأصل في 16 أغسطس 2019.
{{استشهاد بخبر}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Critics warn of 'totally unacceptable' risk to humans after meat from 21 tainted elk herds enters food supply". CBC. 15 أغسطس 2019. مؤرشف من الأصل في 2019-08-28.
- ^ ا ب "Deer hunting rules relaxed to curb deadly disease". CBC. 9 سبتمبر 2019. مؤرشف من الأصل في 2019-09-10.
- ^ Benestad، Sylvie L.؛ Mitchell، Gordon؛ Simmons، Marion؛ Ytrehus، Bjørnar؛ Vikøren، Turid (1 يناير 2016). "First case of chronic wasting disease in Europe in a Norwegian free-ranging reindeer". Veterinary Research. ج. 47 ع. 1: 88. DOI:10.1186/s13567-016-0375-4. ISSN:0928-4249. PMC:5024462. PMID:27641251.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Chronic Wasting Disease in Norway". Norwegian Food Safety Authority. 15 سبتمبر 2016. مؤرشف من الأصل في 2019-02-23. اطلع عليه بتاريخ 2018-03-12.
- ^ "Nytt tilfelle av CWD på villrein". Norwegian Veterinary Institute (بالنرويجية). 29 Aug 2016. Archived from the original on 2019-04-01. Retrieved 2018-03-12.
- ^ Norwegian Food Safety Authority. Chronic Wasting Disease in Norway. Published July 13, 2016; updated July 14, 2016 نسخة محفوظة 2019-02-23 في Wayback Machine
- ^ "Moose found dead in forest with chronic wasting disease". Evira. 8 مارس 2018. مؤرشف من الأصل في 2018-06-24. اطلع عليه بتاريخ 2018-03-12.
- ^ Avmagringssjuka (CWD) upptäckt på älg i Norrbottens län - SVA نسخة محفوظة 2019-03-27 في Wayback Machine
- ^ "Chronic Wasting Disease" (PDF). مؤرشف من الأصل (PDF) في 2019-07-09.
- ^ Christina J. Sigurdson et Adriano Aguzzi « Chronic wasting disease » Biochim Biophys Acta. 2007 Jun;1772(6):610-8 نسخة محفوظة 2020-03-12 في Wayback Machine
- ^ ا ب (بالإنجليزية) E. S. Williams « Chronic Wasting Disease » Veterinary Pathology 2005;42(5):530-549. دُوِي:10.1354/vp.42-5-530 ([1]) نسخة محفوظة 2016-08-05 في Wayback Machine
- ^ ا ب Saunders، S.E.؛ Bartelt-Hunt، S.L.؛ Bartz، J.C. (2012). "Occurrence, transmission, and zoonotic potential of chronic wasting disease". Emerging Infectious Diseases. ج. 18 ع. 3: 369–376. DOI:10.3201/eid1803.110685. PMC:3309570. PMID:22377159.
- ^ ا ب Selariu، A.؛ Powers، J.G.؛ Nalls، A.؛ Brandhuber، M.؛ Mayfield، A...&؛ Mathiason، C.K. (2015). "In utero transmission and tissue distribution of chronic wasting disease-associated prions in free-ranging Rocky Mountain elk". Journal of General Virology. ج. 96: 3444–55. DOI:10.1099/jgv.0.000281. PMC:4806583. PMID:26358706.
- ^ Williams، E.S.؛ Young، S. (1980). "Chronic wasting disease of captive mule deer: A Spongiform Encepalopathy". Journal of Wildlife Diseases. ج. 16 ع. 1: 89–98. DOI:10.7589/0090-3558-16.1.89.
- ^ Wisniewski، T.؛ Goni، F. (2012). "Could immodulation be used to prevent prion diseases?". Expert Review of Anti-Infective Therapy. ج. 10 ع. 3: 307–317. DOI:10.1586/eri.11.177. PMC:3321512.
- ^ Mitchell، Gordon B.؛ Sigurdson، Christina J.؛ O’Rourke، Katherine I.؛ Algire، James؛ Harrington، Noel P.؛ Walther، Ines؛ Spraker، Terry R.؛ Balachandran، Aru (18 يونيو 2012). "Experimental Oral Transmission of Chronic Wasting Disease to Reindeer (Rangifer tarandus tarandus)". PLoS ONE. ج. 7 ع. 6: e39055. DOI:10.1371/journal.pone.0039055. ISSN:1932-6203. PMC:3377593. PMID:22723928.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Lohrer، Lydia (26 نوفمبر 2017). "Hunters must change approach, help stall CWD from spreading to humans". Detroit Free Press. مؤرشف من الأصل في 2020-03-12. اطلع عليه بتاريخ 2017-11-26.
| في كومنز صور وملفات عن: مرض الهزال المزمن |
